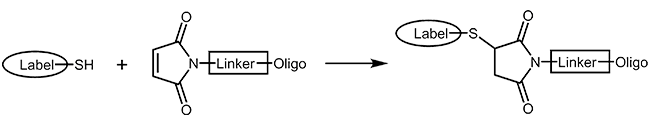Modifikationschemie
Modifikationen können entweder während der automatisierten Synthese oder post-synthetisch (nach Abspaltung vom Support) an ein Oligo gekoppelt werden. Verschiedene Methoden sind möglich. Ihre Anwendbarkeit hängt von der Verfügbarkeit der Reagentien ab, aber auch von der Position, an der die Modifikation im Oligo eingeführt werden soll – 5‘, 3‘ oder intern. Die chemische Modifikation von Oligos ist dabei deutlich effizienter als enzymatische Methoden und ergibt deutlich höhere Produktausbeuten.
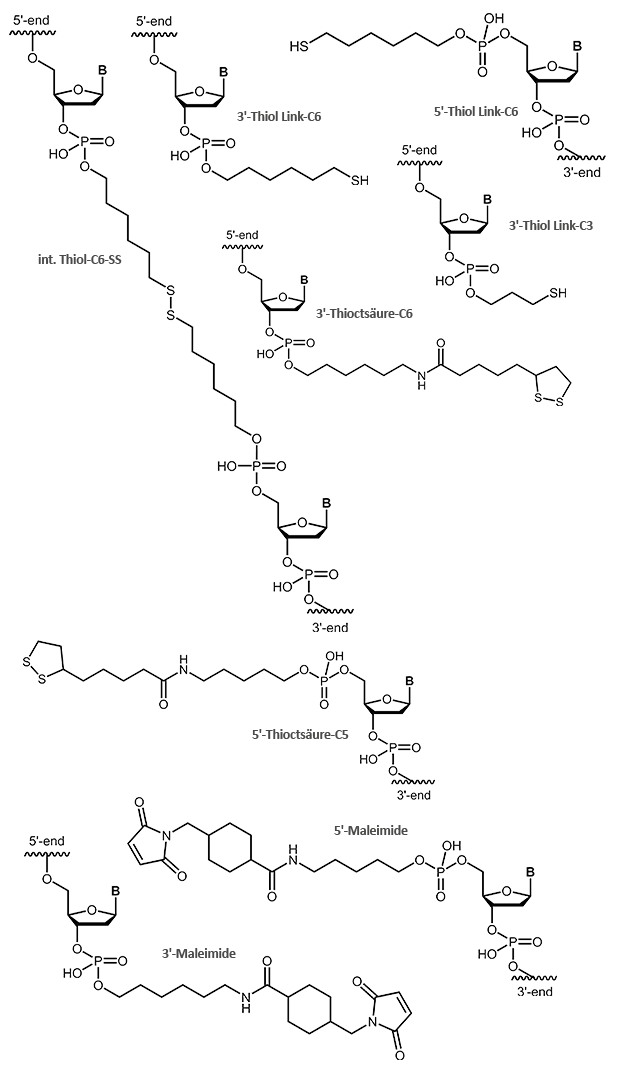
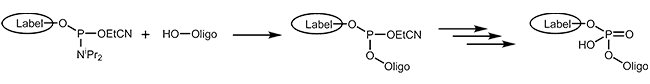
Phosphoramidite
Phosphoramidite
Die einfachste und schnellste Möglichkeit, ein Oligo mit einer Modifikation am 5'-Ende oder intern zu versehen, ist die Ankopplung eines Phosphoramidits während der Oligosynthese. Grundvoraussetzung für dieses Verfahren ist natürlich, dass die jeweiligen Modifikationen als Phosphoramiditbaustein zur Verfügung stehen. Weiterhin müssen die Modifikationen gegenüber allen im weiteren Verlauf der Synthese verwendeten Reagentien stabil sein, so daß sie diese - insbesondere die Träger- und Schutzgruppenabspaltung - unbeschadet überstehen.
Viele Farbstoffe und Labels Markierungen (z. B. Fam, Hex, Tet, Cyanine 3, Biotin etc.), aber auch Linker mit reaktiven Gruppen (Aminolink, Thiol etc.), die später weiter modifiziert werden können, werden auf diese Weise eingebaut.
 |
NHS-Ester und Aminolink
NHS-Ester und Aminolink
Viele Fluoreszenzfarbstoffe und Biomoleküle können in Form ihrer reaktiven N-Hydroxy-Succinimid-Ester (NHS-Ester) an Oligonucelotide mit primärer Aminofunktion (Aminolinker) gekoppelt werden. Der NHS-Ester wird dazu in wässrig-organischer Lösung in einem postsynthetischen Reaktionsschritt mit dem Oligo umgesetzt. Unter Ausbildung einer Amidbindung wird die Modifikation kovalent an das Oligo gebunden. Da diese Reaktionen üblicherweise nie ganz vollständig ablaufen, ist eine sorgfältige Aufreinigung des Produkts über HPLC erforderlich.
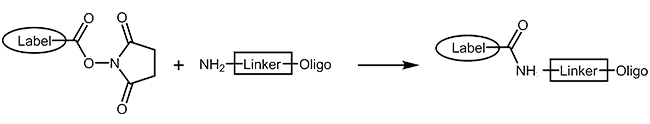 |
Thiol und Maleimid
Thiol und Maleimid
Thiole und Maleimide reagieren leicht miteinander und ergeben eine stabile kovalente Verknüpfung beider Moleküle. Hierfür kann das Oligo entweder mit Thiol oder Maleimid aktiviert werden, je nachdem in welcher Form die Modifikation zur Verfügung steht. Beide Varianten sind möglich.
|
|
Click Chemie
Click Chemie
Der Begriff „Click-Chemie“ beschreibt üblicherweise eine stark thermodynamisch begünstigte, schnelle Reaktion, die eine effiziente und selektive Verknüpfung zweier Moleküle ermöglicht. Im engeren Sinne versteht man unter „Click-Reaktion“ heutzutage eine Cycloadditionsreaktion zwischen einem Azid und einem Alkin. Es wird unterschieden zwischen der kupfer-katalysierten Azid-Alkin-Cycloaddition und der kupfer-freien Click Chemie. Die Click-Reaktion verläuft sehr effizient in wässrigem Medium und ist daher für die Anknüpfung von Modifikationen an Biomoleküle oder die Verknüpfung von unterschiedlichen Biomolekülen geeignet. Sie ist weitgehend unempfindlich gegenüber anderen funktionellen Gruppen (z.B. Amino, Carboxy) und eröffnet daher viele Möglichkeiten.
| Kupfer-katalysierte Azid-Alkin-Cycloaddition: |
|---|
|
Die kupferkatalysierte Azid-Alkin-Cycloaddition (CuAAC, engl.: copper-catalysed azide-alkyne cycloaddition)1,2 ist eine Weiterentwicklung der von Huisgen beschriebenen klassischen Azid-Alkin-Cycloaddition3. In beiden Fällen entsteht aus einem terminalen Alkin und einem Azid ein 1,2,3-Triazol. Die kupferkatalysierte Version (CuAAC) hat dabei den Vorteil, dass sie regioselektiv ist und bei Raumtemperatur um ein Vielfaches schneller abläuft als die ursprüngliche Huisgen-Reaktion, welche hohe Temperaturen erfordert und dabei noch regioselektiv ist. So wird bei der CuAAC nur das 1,4-Regioisomer des Triazols gebildet. |
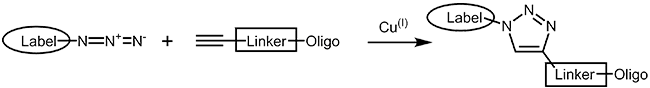 |
| Kupfer-freie Click-Reaktion: |
|---|
|
Der Kupferkatalysator ist toxisch für Bakterien und Säugetierzellen. Für Click-Chemie unter physiologischen Bedingungen wurden Reaktionen entwickelt, die ebenso zielgerichtet und schnell ablaufen wie die CuAAC aber auf Metall-Ionen verzichten können. Ein kurzer Review-Artikel von Becer et al.4 gibt eine gute Übersicht. Vielfache Anwendung findet die Reaktion von Aziden mit verschiedentlich substituierten Cyclooctinen5, die aufgrund der ungünstigen Ringspannung im Cyclooctinring stark erleichtert wird. |
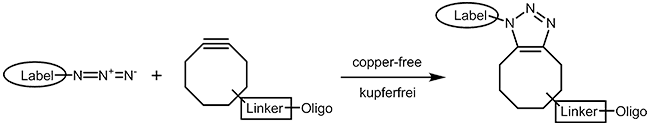 |
Literatur:
1. Tornøe CW, Christensen C, Meldal MJ. 2002. Peptidotriazoles on solid phase: [1,2,3]-Triazoles by regiospecific Copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. Org. Chem. 67, 3057-3064.
2. Rostovtsev VV, Green LG, Fokin VV, Sharpless KB. 2002. A stepwise Huisgen cycloaddition process: Copper(I)-catalyzed regioselective ligation of azides and terminal alkynes. Angew. Chem. Int. Ed. Engl. 41, 2596-2599.
3. Huisgen R. 1961. 1,3-Dipolar cycloadditions. Proc. Chem. Soc. 357-396.
4. Becer CR, Hoogenboom R, Schubert US. 2009. Click chemistry beyond metal-catalyzed cycloaddition. Angew. Chem. Int. Ed. 48, 2-11
5. Agard NJ, Prescher JA, Bertozzi CR. 2004. A Strain-promoted [3 + 2] Azide−alkyne cycloaddition for covalent modification of biomolecules in living systems. J. Am. Chem.Soc. 126, 15046-15047