
Oligonucleotide zur elektrochemischen Detektion
Oligos mit Redoxmodifikationen
Methylenblau, Ferrocen, Anthrachinon, Viologen, Atto MB2 und Nile Blue-
Oligonucleotide mit Redox-aktiven Reportermolekülen
In den letzten Jahren wurde eine Vielzahl neuer Ansätze von Oligonucleotid-basierten elektrochemischen Biosensoren, sogenannte E-Sensoren, entwickelt. Diese Form der Biosensoren stellt eine äußerst sensitive und selektive Methode zum Nachweis bestimmter DNA-Sequenzen dar (z.B. SNP-Detektion).
Alle DNA-basierten elektrochemischen Sensoren basieren auf der Wechselwirkung zwischen einem Target-Molekül in Lösung, einer Target-bindenden Sonde und einer festen Elektrodenoberfläche.
Viele der hierbei zur Detektion eingesetzten Oligonucleotidsonden werden an einem Ende mit einer Redox-Modifikation markiert und über das andere, freie Ende an eine leitende Oberfläche (z.B. Elektrode) gebunden.
Die kovalente Anbindung dieser Redox-aktiven Oligosonden an leitende Oberflächen wie Goldelektroden wird dabei über eine terminale Thiol- oder Thioctsäure-Modifikation erreicht.
Für eine effektive Detektion stehen verschiedene Redox-aktive Reporter zur Verfügung:
In Abwesenheit eines komplementären Strangs nehmen Redox-aktive Oligosonden eine bestimmte Konformation ein, wobei zwischen Sonde und Elektrode ein definierter Abstand besteht.
Die Hybridisierung eines komplementären Target-Moleküls an das an der Oberfläche gebundene Oligo führt zu einer Konformationsänderung. Hierdurch wird der Elektronentransfer zwischen Redoxeinheit und Elektrode beeinflusst und die Potenzialänderung kann über geeignete Messmethoden detektiert werden.
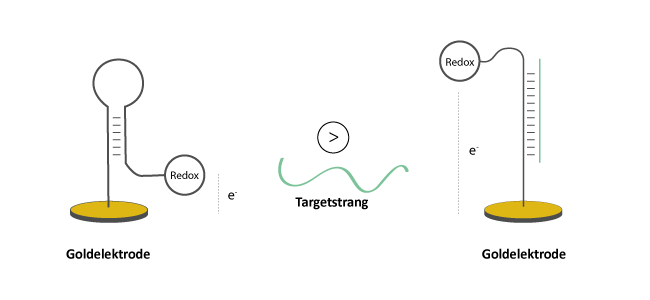
Abbildung 1: Konformationsänderung einer Oligosonde mit Redoxmodifikation (Methylenblau, Ferrocen, Anthrachinon, Viologen, Atto MB2 oder Nile Blue) nach Hybridisierung eines komplementären Targetstrangs. Die daraus resultierende Änderung im Elektrodenpotenzial kann gemessen werden.
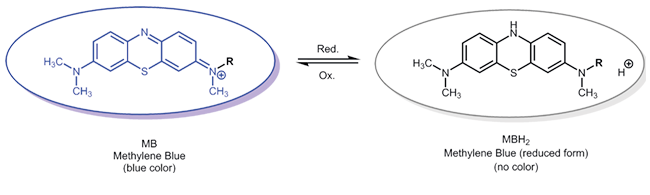
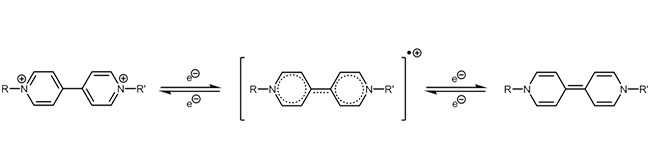
Oxidation-Reduktion Reaktion Redox-aktiver Reportermoleküle - Methylenblau
Ferrocen
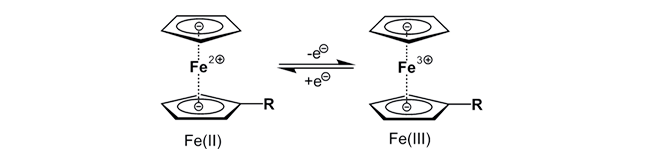
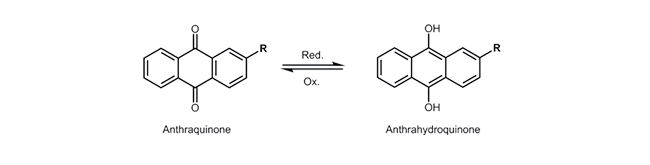
Anthrachinon
Viologen
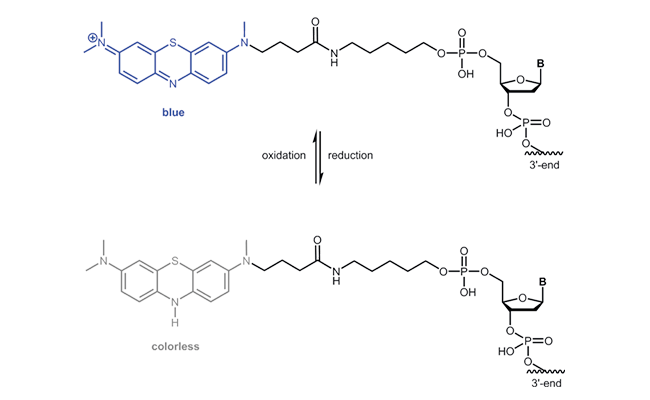
Atto MB2
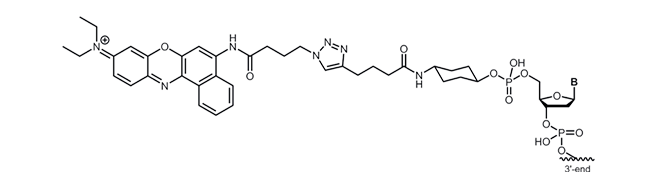
Nile Blue
biomers.net bietet die Redoxmodifikationen Ferrocen, Methylenblau, Anthrachinon, Viologen, Atto MB2 und Nile Blue als 3´-und 5´-Modifikation an.
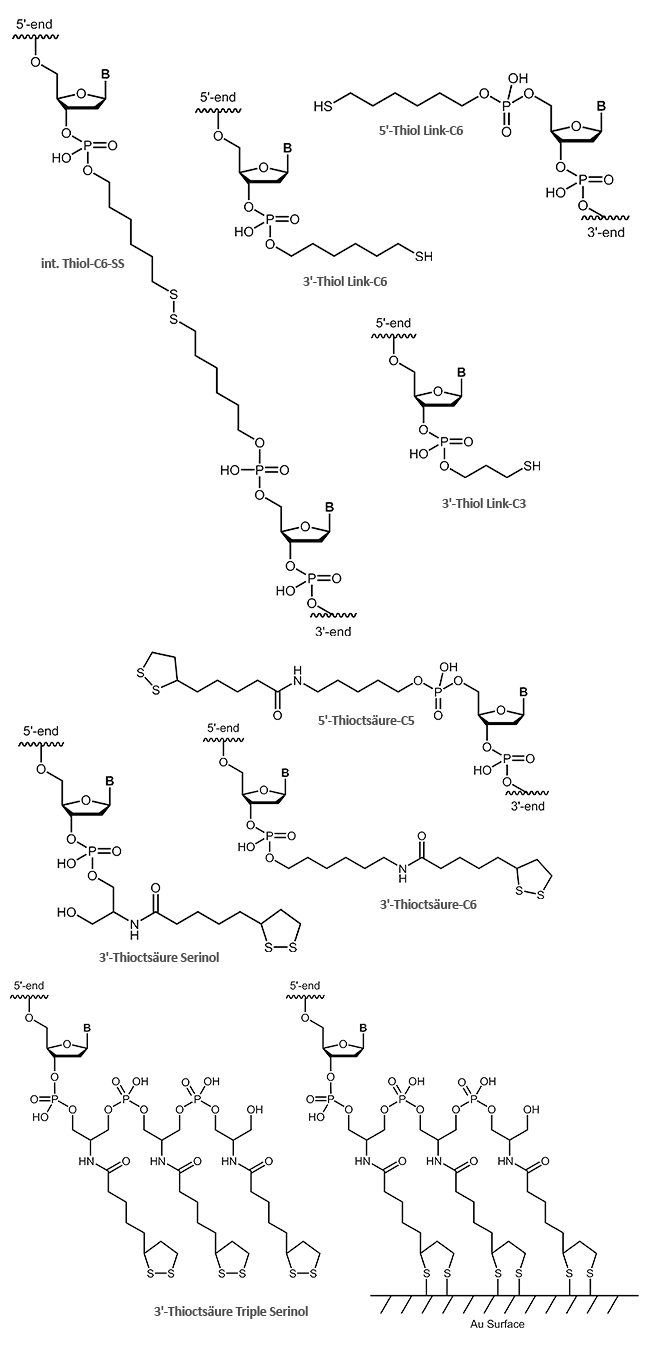
Zusätzlich zur Redoxmarkierung am 5´-Ende kann das Oligonucleotid auf Wunsch am freien 3´-Terminus mit einem Thiol oder einer Thioctsäure markiert werden.
Gerne stehen wir Ihnen jederzeit für weitere Details zur Verfügung.
Tel +49 731 70 396 0 ǀ info@biomers.net
Literatur:
1. Comparing the Properties of Electrochemical-Based DNA Sensors Employing Different Redox Tags. Kang D, Zuo X, Yang R, Xia F, Plaxc, KW, White R; Anal Chem. (2009), 81(21): 9109–9113.
2. Ferrocene-oligonucleotide conjugates for electrochemical probing of DNA. Ihara T, Maruo Y, Takenaka S, Takagi M; Nucleic Acids Res (1996), 24. 4273.
3. DNA biomolecular-electric encoder and decoder devices constructed by multiplex biosensors. Kang D, White RJ, Xia F, Zuo X, Vallée-Bélisle A, Plaxco KW; NPG Asia Materials (2012), 4, doi:10.1038/am.2012.1.
4. Uridine-Conjugated Ferrocene DNA Oligonucleotides: Unexpected Cyclization Reaction of the Uridine Base. Yu CJ, Yowanto H, Wan Y, Meade TJ, Chong Y, Strong M, Donilon LH, Kayyem JF, Gozin, M, Blackburn GFJ; Am. Chem. Soc. (2000), 122, 6767-6768.
5. 2´-Ribose-Ferrocene Oligonucleotides for Electronic Detection of Nucleic Acids. Yu CJ, Wang H, Wan Y, Yowanto H, Kim JC, Donilon LH, Tao C, Strong M, Chong YJ; Org. Chem. (2001), 66, 2937-2942.
Oligos zur Oberflächenimmobilisierung
Modifikationen für die Immobilisierung auf leitenden Oberflächen
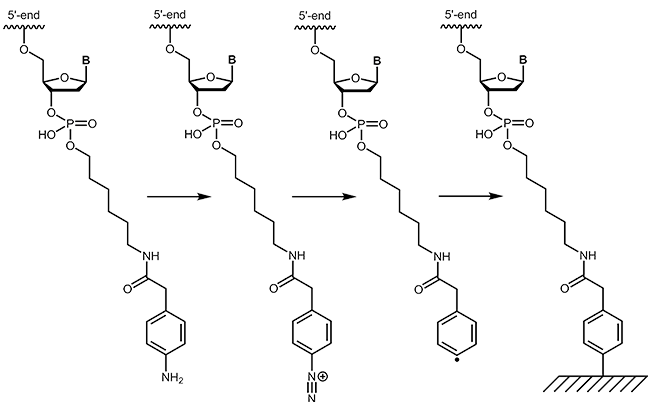
Zur kovalenten Anbindung von Oligonucleotiden an leitende Oberflächen sind verschiedene Strategien verfügbar. Neben der Kopplung an Goldoberflächen über Thiol- und Thioctsäureverbindungen besteht die Möglichkeit Oligonucleotide auch über 4-Carboxymethylanilin an leitende Oberflächen wie Graphit zu binden.
Thiol- und Thioctsäure-Modifikation am Oligo zur Bindung an Goldoberflächen
Für die Kopplung von Oligonucleotiden an Goldoberflächen eignet sich neben dem einfachen endständigen reaktiven Thiol (SH-Gruppe) auch die Thioctsäure-Modifikation, die aufgrund ihrer zwei Schwefelatome noch fester an die Oberfläche binden kann. Noch weitaus höhere Bindungsaffinitäten kann das Thioctsäure-Triple erzielen, das mit sechs Schwefelatomen fest an die Goldoberfläche bindet.
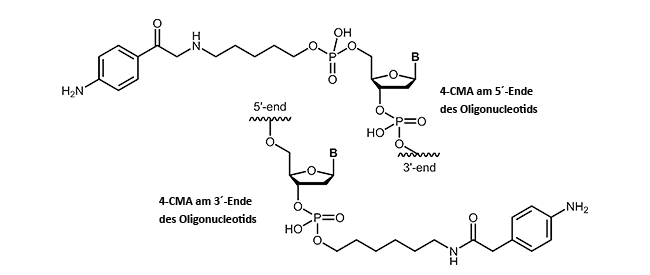
4-Carboxymethylanilin-modifizierte Oligonucleotide
4-Carboxymethylanilin (4-CMA) bietet die Möglichkeit, die daran gekoppelten Biomoleküle gezielt an entsprechend vorbereitete Oberflächen zu immobilisieren. Auf diese Weise ist die Bindung von Oligonucleotiden auch an leitende Oberflächen (z.B. Graphit) möglich, sodass Ströme gemessen werden und Strukturänderungen der gekoppelten DNA eine Art „Schalter-Wirkung“ haben können. Durch die Kopplung, wahlweise an den 5´- oder 3´-Terminus von Oligonucleotiden, werden die Moleküle in der gewünschten Orientierung kovalent an die Oberfläche gebunden.
Literatur:
- Diazonium-Protein Adducts for Graphite Electrode Microarrays Modification: Direct and Addressed Electrochemical Immobilization. Corgier BP, Marquette CA, Blum LJ; Journal of the American Chemical Society, (2005), 127, 18328-18332.
- A versatile method for direct and covalent immobilisation of DNA and proteins on biochips. Corgier BP, Laurent A, Perriat P, Blum LJ, Marquette CA; Angewandte Chemie International (2007), 46, 4108-4110.
- On-Chip Chemiluminescent Signal Enhancement using Nanostructured Gold-Modified Carbon Microarrays. Corgier BP, Li F, Blum LJ, Marquette CA; Langmuir (2007), 23(16), 8619-8623.

