
Methylierung
N6-Methyl-Adenosin
N6-Methyl-Adenosin (m6A)
|
N6-Methyl-Adenosin (m6A) ist eine häufige interne Modifikation in natürlichen mRNA-Strängen bei Eukaryoten. Trotz der ersten Entdeckung in den 1970er Jahren ist die biologische Bedeutung von N6-Methyl-Adenosin bisher nicht vollständig geklärt und Gegenstand aktueller epigenetischer Forschung. Wir bieten Ihnen synthetische RNA-Oligonucleotide mit N6-Methyl-Adenosin (m6A) für Ihre Forschung an. Fragen Sie unseren Kundensupport nach Verfügbarkeit und Lieferzeit. |
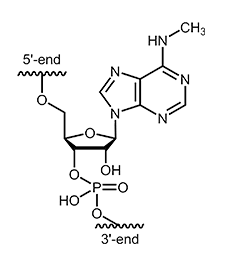 |
Literatur:
1. N6-methyladenosine-dependent regulation of messenger RNA stability. Wang X, Lu Z, Gomez A, Hon GC, Yue Y, Han D, Fu Y, Parisien M, Dai Q, Jia G, Ren B, Pan T, He C; Nature 505 (2014), 117–120.
2. N6-methyl-adenosine (m6A) in RNA: An Old Modification with A Novel Epigenetic Function. Niu Y, Zhao X, Wu Y-S, Li M-M, Wang X-J, Yang Y-G; Genomics Proteomics Bioinformatics 11 (2013), 8–17.
3. Comprehensive Analysis of mRNA Methylation Reveals Enrichment in 3' UTRs and near Stop Codons. Meyer KD, Saletore Y, Zumbo P, Elemento O, Mason CE, Jaffrey SR; Cell 149 (2012), 1635–1646.
5-Me-dC und 5-hm-dC
5-Methyl-2’-desoxycytidin und 5-Hydroxymethyl-2’-desoxycytidin
biomers.net bietet Ihnen sowohl Oligonucleotide mit 5-Methyl-2’-desoxycytidin (5-Me-dC)-, als auch mit
5-Hydroxymethyl-2’-desoxycytidin (5-hm-dC) – Modifikationen im Scale S, M und L an:
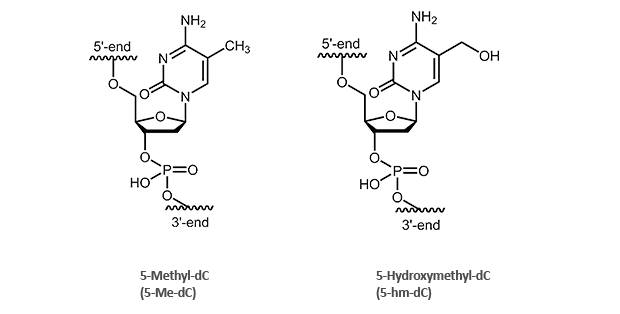 |
5-Methyl-2’-desoxycytidin (5-Me-dC)
Methylierungen an Cytosin-Basen werden von eukaryotischen Zellen genutzt, um genübergreifende Abschnitte zu regulieren, bekanntestes Beispiel ist sicherlich das "Silencing" ganzer Chromosomen. Das Forschungsgebiet der Epigenetik befasst sich mit der Analyse solcher Effekte, die über die in den Basen kodierten Eigenschaften der Erbinformation hinausgehen. Die Methylierung der DNA ist sorgfältig reguliert und hat wesentlichen Einfluss auf das "korrekte" Verhalten von Zellen im Gesamtorganismus. Deshalb ist auch im Bereich der Tumorforschung die Methylierung in den Forschungsfokus getreten, nachdem festgestellt wurde, dass die Methylierungsmuster der DNA von Tumorzellen sich von gesunden Zellen unterscheiden. Die daraus resultierende unterschiedliche Aktivität der genetischen Information ist ein wesentlicher Teilaspekt der Tumorentwicklung. Um die tatsächlichen regulativen Prozesse zu untersuchen, muss oft die methylierte Position genau bekannt und idealerweise auch veränderbar sein. Dies wird möglich mit Oligonucleotiden, die an definierten Stellen methylierte Cytosine tragen.
5-Hydroxymethyl-2’-desoxycytidin (5-hm-dC)
5-Hydroxymethylcytosin konnte bereits Anfang der 1950er-Jahre durch Wyatt und Cohen aus Bakteriophagen-DNA isoliert werden1. In den Fokus epigenetischer Forschung jedoch rückte diese sogenannte „sechste Base“ erst in jüngster Zeit nachdem signifikante Mengen an 5-hm-dC auch in unterschiedlichen Zellgeweben (Gehirn, Leber) gefunden wurden2,3.
Mit der üblichen „Bisulfit-Sequenzierung“, die vielfach für Methylierungs-Studien verwendet wird, kann offensichtlich nicht zwischen 5-Me-dC und 5-hm-dC unterschieden werden4. Diese Feststellungen legen für die detaillierte Verifizierung des Methylierungsgrades von DNA neue Techniken nahe. So kann beispielsweise 5-hm-dC selektiv enzymatisch glycosiliert5,6 oder wie jüngst von Booth et al. beschrieben mild oxidiert7 und somit in nachfolgenden Schritten von 5-Me-dC unterschieden werden.
Literatur:
1. A new pyrimidine base from bacteriophage nucleic acids. Wyatt GR, Cohen SS; Nature (1952), 170: 1072.
2. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Kriaucionis S, Heintz N; Science (2009), 324: 929.
3. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Tahiliani M, Koh KP, Shen Y, Pastor WA, Bandukwala H, Brudno Y, Agarwal S, Iyer LM, Liu DR, Aravind L, Roa A; Science (2009), 324: 930.
4. Enzymatic approaches and bisulfite sequencing cannot distinguish between 5-methylcytosine and 5-hydroxymethylcytosine in DNA. Nester C, Ruzov A, Meehan RR, Dunican DD, BioTechniques (2010), 48, 317.
5. A novel method for the efficient and selective identification of 5-hydroxymethylcytosine in genomic DNA. Robertson AB, Dahl JA, Vagbo CB, Tripathi P, Krokan HE, Klungland A, Nucleic Acids Research (2011), 39, e55.
6. Selective chemical labeling reveals the genome-wide distribution of 5-hydroxymethylcytosine. Song CX, Szulwach KE, Fu Y, Dai Q, Yi C, Li X, Li Y, Chen C, Zhang W, Jian X, Wang J, Zhang L, Looney TJ, Zhang B, Godley LA, Hicks LM, Lahn BT, Jin P, He C, Nature Biotechnology (2011), 29, 68.
7. Quantitative Sequencing of 5-Methylcytosine and 5-Hydroxymethylcytosine at Single-Base Resolution. Booth MJ, Branco MR, Ficz G, Oxley D, Krueger F, Reik W, Balasubramanian S; Science (2012), 336, 934.

