Click-Chemie
Einleitung
Bioorthogonales Labelling über Click-Chemie
Zur Erforschung der Funktion eines Biomoleküls sind vor allem Informationen über den Wirkort des jeweiligen Moleküls, die räumliche und zeitliche Verteilung sowie mögliche Wechselwirkungen mit anderen Biomolekülen zwingend notwendig. Jedoch ist aufgrund der Komplexität und der geringen Konzentrationen der gesuchten Moleküle die genaue Erforschung der Funktion oft schwierig. Um in lebenden Zellen oder Organismen das „Trafficking“ interessanter Moleküle verfolgen zu können, ist ein "Labelling" oder "Tagging" erforderlich, dass allerdings mit den gängigen Ansätzen begrenzt ist:
- Markierung mit chemischen Modifikationen (z.B. mit Fluoreszenzfarbstoffen): dies hängt weitgehend von wenigen, häufig vorkommenden "Anknüpf-Möglichkeiten" ab, wie Amino-Gruppen oder Thiol-Verbindungen, wodurch
sich oft heterogene Markierungen ergeben. - Markierung über gentechnisch modifizierte Protein-Tags (vor allem GFP): hier kann aufgrund der schieren
Größe der Tags die Funktion des markierten Moleküls beeinflusst werden. Zudem beschränkt sich diese Methode auf Proteinanalysen und ist für andere Moleküle wie Nucleinsäuren, Zucker oder Lipide ungeeignet.1
Diese Einschränkungen können dank der Fortschritte im “bioorthogonalen Labelling” nun überwunden werden. Obwohl die Grundlagen in eher synthetisch-chemischen Überlegungen begründet sind, entdecken und erforschen Life-science-Wissenschaftler zunehmend die Möglichkeiten, Biomoleküle mit minimalem Einfluss auf deren Funktion zu markieren.
Die wichtigsten Vorteile sind hierbei:
- die Tags werden über kleine Moleküle eingefügt (somit minimaler Einfluss auf die Funktion)
- extrem schnelle Reaktionskinetik
- einfache Reaktionsbedingungen, die stabile und nicht-toxische Produkte in wässrigen Lösungen erlauben
- mehrere „nicht-biologische“ Tags können kombiniert werden, sodass verschiedene Biomoleküle parallel untersucht werden können.
Grundlegend für diesen Fortschritt waren die Bemühungen von K. Barry Sharpless, die Herstellung großer, komplexer Biomoleküle wie in der Natur durch den Einsatz einfacher Bausteine und einer Kohlenstoff-Heteroatom Verbindung nachzuahmen. Sharpless führte im Jahr 2011 den Begriff der „Click-Chemie“ 2 ein und beschreibt damit eine ganze Reihe von schnellen und thermodynamisch begünstigten Reaktionen, die die effiziente und selektive Verknüpfung zweier Moleküle ermöglicht.
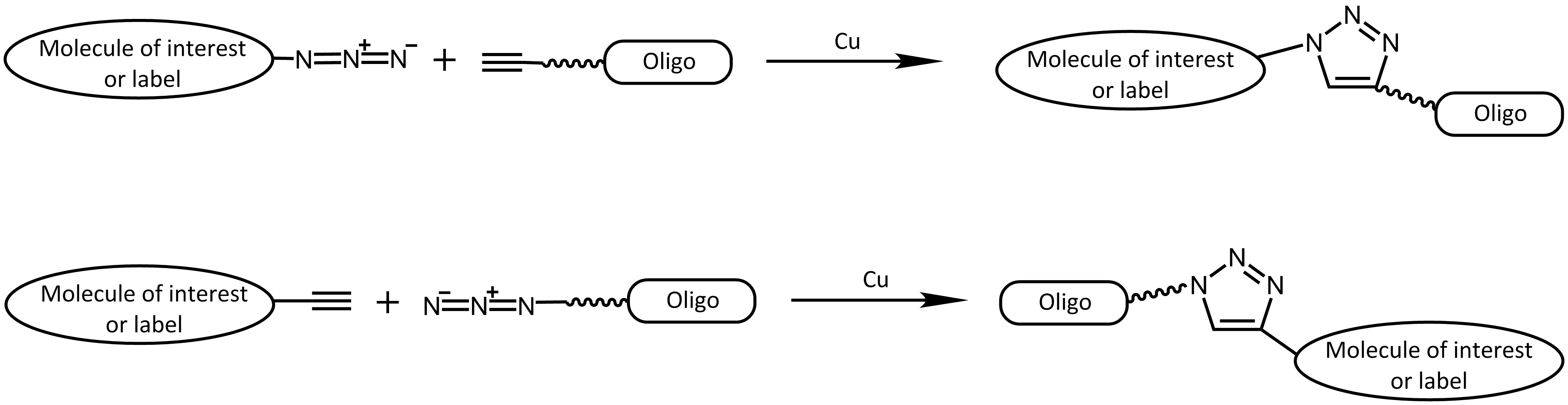
Genauer ist die Click-Reaktion eine Cycloaddition zwischen einem Azid und einem Alkin. Ursprünglich war die kupferkatalysierte Azid-Alkin-Cycloaddition (CuAAC) 2 eine Verbesserung der klassischen Huisgen Cycloaddition.3
In beiden Fällen reagiert ein terminales Alkin mit einem Azid zu einem 1,2,3 Triazol.
Im Vergleich zur ursprünglichen Huisgen Reaktion, die sehr langsam und nicht regioselektiv ist und darüberhinaus nur bei erhöhter Temperatur funktioniert, ist die kupferkatalysierte Version um ein Vielfaches schneller, läuft effizient bei Raumtemperatur und liefert das 1,4-Regioisomer des Triazols.
Sowohl ein Azid, als auch ein Alkin können einfach und zuverlässig an ein Oligonucleotid angebracht werden.
Kupferkatalysierte Azid-Alkin Cycloadditionsreaktion (CuAAC)
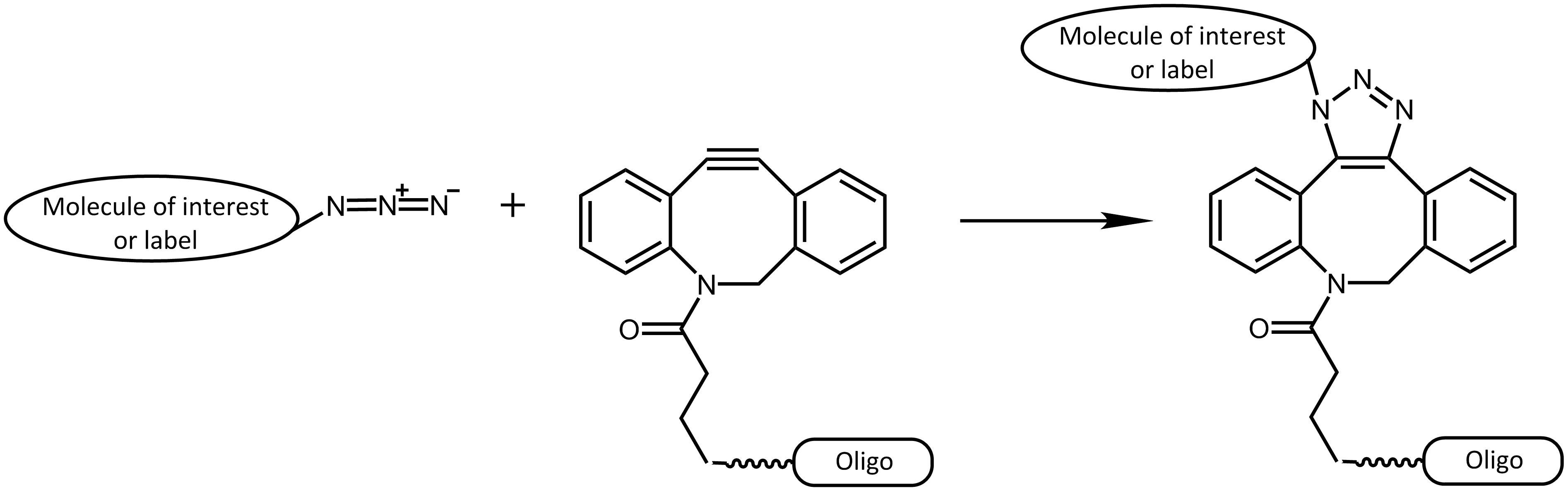
Eine Einschränkung in der Anwendbarkeit in lebenden Zellen ergibt sich durch die Zytotoxizität des Kupferkatalysators, deshalb findet diese Reaktion vornehmlich in vitro Anwendung (Ausnahme siehe z.B. 4 - DelAmo, 2010). Andererseits sind die reaktiven Gruppen von Azid und Alkin sehr klein und kommen natürlich nicht vor, was diese Art der Reaktion für viele Ansätze sehr interessant macht. Weitere Fortschritte erzielten die Arbeiten von Bertozzi et al.5 Durch Verwendung eines Azid-reaktiven, gespannten Cyclooctin-Rings konnte auf den Einsatz eines Kupferkatalysators verzichtet werden. Die Spannung innerhalb des Rings genügt hierbei, um eine schnelle Reaktion zu gewährleisten, sodass diese nicht-toxische Form auch in lebenden Zellen angewendet werden kann.
Strain-Promoted Azide-Alkyne Cycloaddition (SPAAC)
Dieser Ansatz wurde in mehreren interessanten Publikationen beschrieben, die verschiedene Techniken zur Markierung von Proteinen durchführten (z.B. 6, 7, 8). Auch auf dem Gebiet der Nanobiotechnologie zeigen Forscher zunehmend Interesse für diese Strategien, da sie die Anwendung verschiedener funktioneller Gruppen ermöglichen.9
Die Tetrazin Ligation 10,11 oder TCO (Tetrazincycloocten) Click-Reaktion beschreibt eine weitere Methode des bioorthogonalen Labellings. Durch die Cycloadditionsreaktion werden ein s-Tetrazin und ein trans-Cycloocten mit extrem hoher Reaktivität in ein zyklisches Alken umgesetzt. Bei dieser Reaktion ist das Tetrazin die reaktive, elektronenreiche Gruppe, die sowohl offenkettig als auch zyklisch vorliegen kann. Unter Eliminierung von Distickstoff N2 werden Tetrazin und die substituierende Gruppe des Cyclooctens an ein Alken gebunden.
Tetrazin Ligation
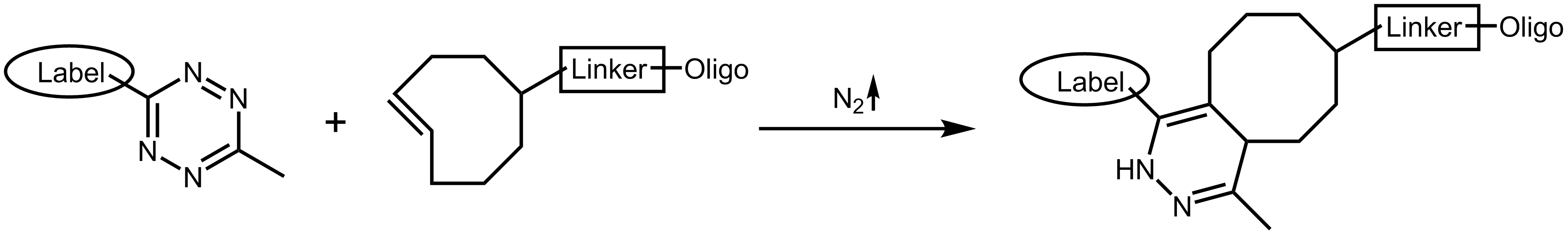
Ein weiteres interessantes Merkmal von Tetrazin ist seine Fähigkeit, die Fluoreszenz einiger Farbstoffe zu „quenchen“. Dabei kann die Fluoreszenz durch die Tetrazin Ligation mit Norbornen oder Cycloocten „gelöscht“ werden.10 Dies ermöglicht einen direkten und sensitiven Nachweis der Ligation.12
Sowohl Tetrazin als auch Cycloocten sind unter physiologischen Bedingungen stabil und beeinträchtigen aufgrund ihrer vergleichsweise geringen Größe die Funktionalität von Biomolekülen nicht wesentlich. Die Reaktion läuft bei sehr niedrigen Konzentrationen mit extrem hoher Geschwindigkeit ab, was die Tetrazin Ligation auch für ein in vivo Imaging interessant macht.13
Literatur:
1. Chemical tags for site-specific fluorescent labeling of biomolecules. Freidel C, Kaloyanova S, Peneva K; (2016), Amino Acids. ; 48(6):1357-72.
2. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Kolb HC, Finn MG, Sharpless KB; (2001), Angew Chem Int Ed Engl.; 1;40(11):2004-2021.
3. Kinetik und Mechanismus 1.3-dipolarer Cycloadditionen. Huisgen, R; (1963), Angew. Chem. Int. Ed. ; 75, (13), 565-598.
4. Biocompatible copper(I) catalysts for in vivo imaging of glycans. Soriano Del Amo D, Wang W, Jiang H, Besanceney C, Yan AC, Levy M, Liu Y, Marlow FL, Wu P; (2010), Journal of the American Chemical Society; 1 32(47).
5. A strain-promoted [3 + 2] azide-alkyne cycloaddition for covalent modification of biomolecules in living systems. Agard NJ, Prescher JA, Bertozzi CR; (2004), J Am Chem Soc.; 126(46):15046-7.
6. A BODIPY-cyclooctyne for protein imaging in live cells. Beatty KE, Szychowski J, Fisk JD, Tirrell DA; (2011), Chembiochem.; 12(14):2137-9.
7. Genetically encoded copper-free click chemistry. Plass T, Milles S, Koehler C, Schultz C, Lemke EA; (2011), Angew Chem Int Ed Engl.; 50(17):3878-81.
8. Imaging the sialome during zebrafish development with copper-free click chemistry. Dehnert KW, Baskin JM, Laughlin ST, Beahm BJ, Naidu NN, Amacher SL, Bertozzi CR; (2012), Chembiochem.;13(3):353-7.
9. The enabled state of DNA nanotechnology. Linko V, Dietz H; (2013), Current Opinion in Biotechnology; 24:1–7.
10. The Tetrazine Ligation: Fast Bioconjugation based on Inverse-electron-demand Diels-Alder Reactivity. Blackman ML, Royzen M, Fox JM; (2008), J Am Chem Soc.; 130(41):13518-9.
11. Genetically encoded tetrazine amino acid directs rapid site-specific in vivo bioorthogonal ligation with trans-cyclooctenes. Seitchik JL, Peeler JC, Taylor MT, Blackman ML, Rhoads TW, Cooley RB, Refakis C, Fox JM, Mehl RA; (2012), Am Chem Soc.; 134(6):2898-901.
12. Rapid oligonucleotide-templated fluorogenic tetrazine ligations. Seckute J, Yang J, Devaraj NK; (2013), Nucleic Acids Research; Vol. 41, No. 1.
13. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Devaraj NK, Weissleder R, Hilderbrand SA; (2008), Bioconjugate Chemistry; 19: 2297-2299.
Kupferkatalysierte Click-Reaktion
Kupferkatalysierte Azid-Alkin-Cycloaddition - CuAAC
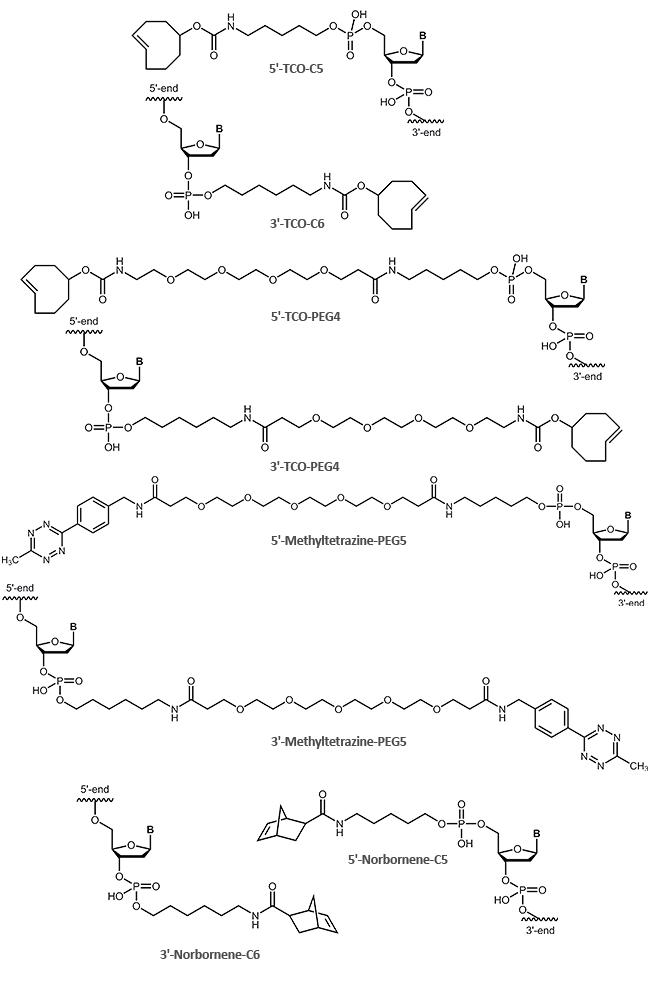
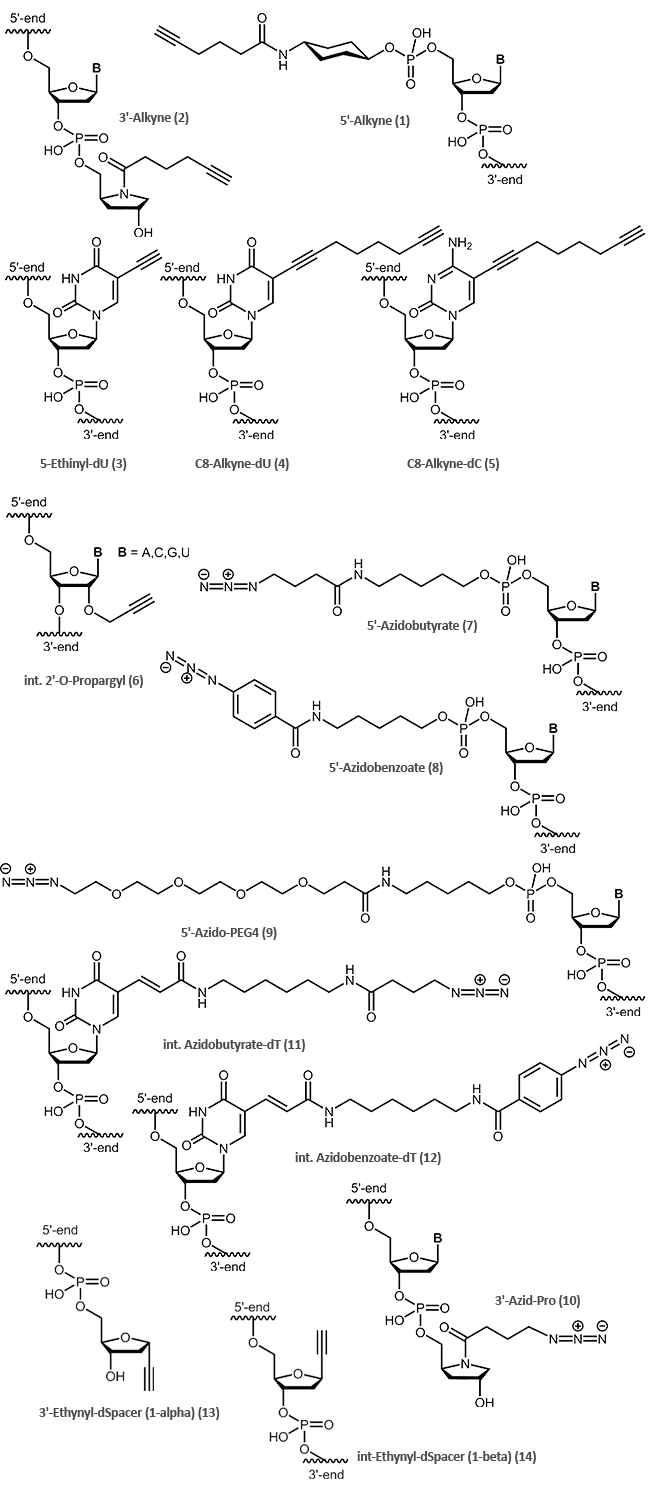
biomers.net bietet die folgenden „clickfähigen“ Modifikationen an:
Zur Kopplung eines reaktionsfähigen Alkins an das 5‘-Ende eines Oligos wird ein Phosphoramidit mit einem Cyclohexyl-Zwischenlinker (1) verwendet, als 3‘-Modifikation kommt ein Alkin-Prolinol-Linker (2) zum Einsatz.
Für interne Alkin-Modifikationen stehen die modifizierten Pyrimidine 5-Ethinyl-dU (3), C8-Alkyne-dU (4) und
C8-Alkyne-dC (5), die eine Alkingruppe über einen Linker an der heterozyklischen Base bereitstellen, sowie die vier 2‘-O-Propargyl-RNA-Bausteine (6), welche eine Alkin-Funktion in der 2‘-Position des Zuckers tragen, zur Verfügung.
Das Azid wird sowohl endständig wie auch intern über Kopplung von Azidobuttersäure, Azidobenzoesäure oder Azido-PEG-Linkern an einen Aminolink bzw. Amino-dT eingeführt (7, 8, 9, 10, 11, 12).
| Modifikation | 5' | 3' | intern |
|---|---|---|---|
| Alkin | (1) | (2),(13) | (3),(4),(5),(6),(14) |
| Azid | (7),(8),(9) | (10) | (11),(12) |
Kupferfreie Click-Reaktion
Kupferfreie Click-Reaktion - Strain promoted Azide-Alkyne Cycloaddition (SPAAC)
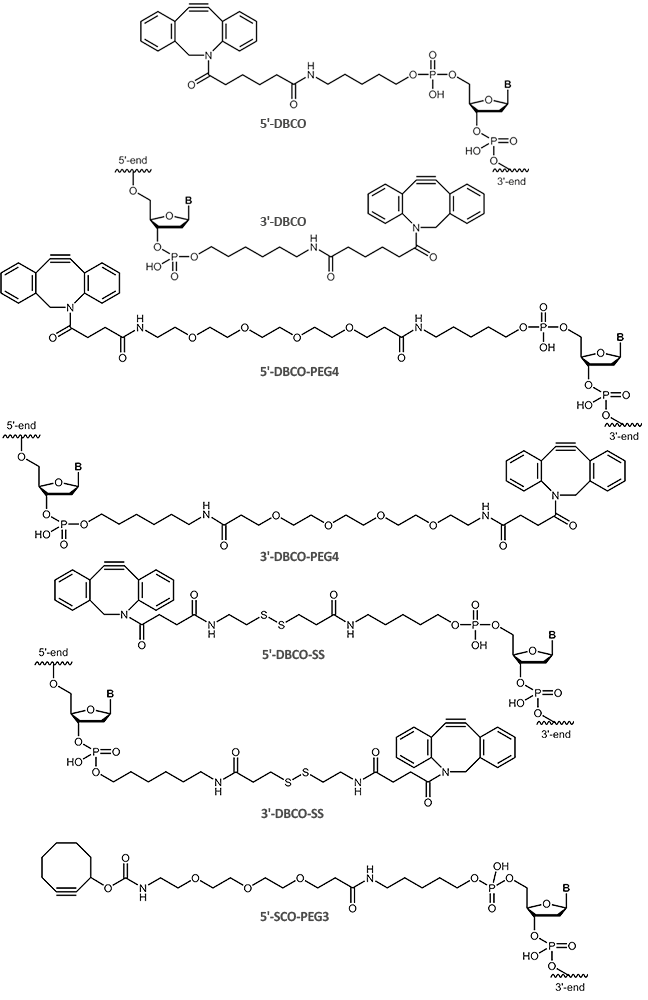
Für kupferfreie Click-Reaktionen existieren diverse Cyclooctin-Derivate, die sich zum Teil deutlich in ihren Reaktionskinetiken und hydrophilen Eigenschaften unterscheiden. Neben dem Cyclooctin DBCO (Dibenzocyclooctyne) ist SCO-PEG3 (Strained Cyclooctyne) ein weiterer Vertreter der Cyclooctine.
DBCO reagiert dabei schnell und selektiv in vielen Reaktionsumgebungen (in vitro und in vivo) mit Aziden zu den entsprechenden Triazolverbindungen.
Als orthogonale Strategie zu herkömmlichen Verknüpfungsreaktionen eignet sich die kupferfreie DBCO-Azid Click-Chemie hervorragend und erlaubt so selektive Mehrfachmarkierungen von Biomolekülen.
Zur kupferfreien Click-Chemie bietet biomers.net Oligonucleotide mit DBCO (Dibenzocyclooctyne) als
5'-und 3´-Modifikation sowie SCO-PEG3 (Strained Cyclooctyne) als 5'-Modifikation an:
Tetrazin-TCO Click-Reaktion
Tetrazin-Ligation
Aufgrund seiner nicht toxischen Eigenschaften ermöglicht diese Form der kupferfreien Click-Variante das in vivo Labelling zellulärer DNA oder Proteine, sowie ein Multiplex Labelling. Auf diese Weise können z.B. Lipide oder andere zelluläre Bestandteile mit einem speziellen Farbstoff markiert werden, der aufgrund verbesserter Photostabilität verlängerte Lebend-Zell-Aufnahmen (3D-Konfokal oder STED-Mikroskopie) ermöglicht und somit besonders hochauflösende mikroskopische Aufnahmen erlaubt.
Für die kupferfreie Tetrazin Click-Reaktion bietet biomers.net Oligonucleotide mit TCO, Tetrazin und Norbornen als 5'- oder 3´-Modifikation an: